Chương trình chất hóa học lớp 12 kha khá dễ nắm bắt nhưng sẽ khá khó nếu như các em bị hụt bài xích hoặc không áp theo kịp. Nhằm củng cầm kiến thức cho những em theo cách đơn giản nhất, Bamboo vẫn tổng hòa hợp lại tất cả các bí quyết hóa học 12 chi tiết nhất trong bài viết dưới đây. Đối với môn học bao gồm lượng kiến thức và kỹ năng lớn, đã dễ hơn không hề ít nếu các em đọc và nắm vững phần kim chỉ nan cơ bạn dạng trước lúc “nuốt trọn” những công thức liên quan. Hãy cùng Bamboo mày mò để cài đặt ngay file PDF tổng hợp những công thức cực dễ ôn tập nhé!
Chương 1: Este – Lipit
Tính số đồng phân este đơn chức no: Tính số triglixerit tạo vì chưng glixerol với các axit cacboxylic béo:Chương 2: Cacbohiđrat
1. Phương pháp chung của cacbohiđrat:
2. Công thức rõ ràng của một số cacbohiđrat:
Tinh bột (hoặc Xenlulozơ): Glucozơ (hoặc Fructozơ): Saccarozơ (hoặc Mantozơ):Chương 3: Amin, Amino axit và Protein
Tính số đồng phân amin đối kháng chức no:Tính số đi, tri, tetra…, n peptit về tối đa tạo vì hỗn hợp tất cả x amino axit không giống nhau: Tính khối luợng amino axit A (chứa n nhóm NH2 với m nhóm COOH ) khi mang đến amino axit này vào dung dịch đựng a mol HCl, kế tiếp cho dung dịch sau phản nghịch ứng tính năng vừa đầy đủ với b mol NaOH:Tính khối luợng amino axit A (chứa n team NH2 cùng m team COOH ) khi đến amino axit này vào dung dịch cất a mol NaOH, tiếp đến cho hỗn hợp sau bội nghịch ứng tác dụng vứa đủ với b mol HCl:Chương 4: Polime và vật tư polime
Công thức tính hệ số trùng hòa hợp polime
Giả sử polime bao gồm dạng (-A-)n
Ta có:
Chương 5: Đại cương cứng về kim loại
1. Dãy chuyển động hóa học của kim loại
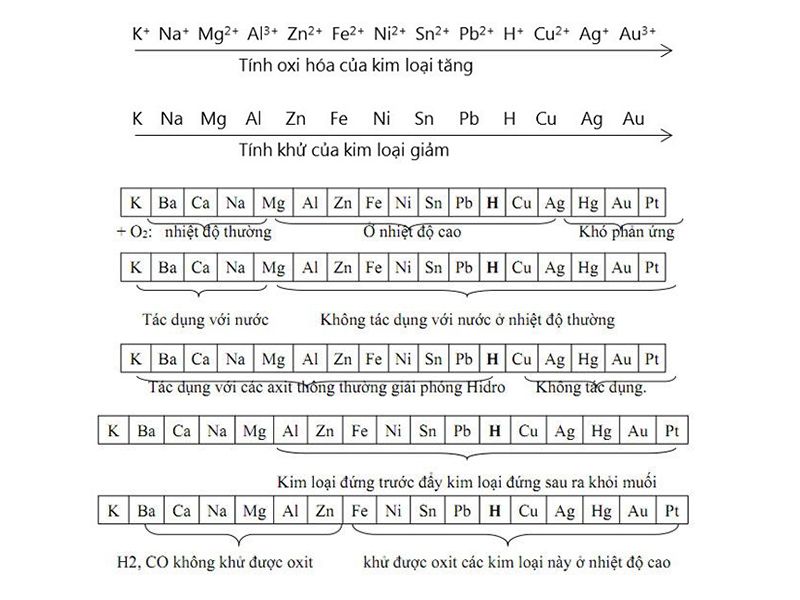
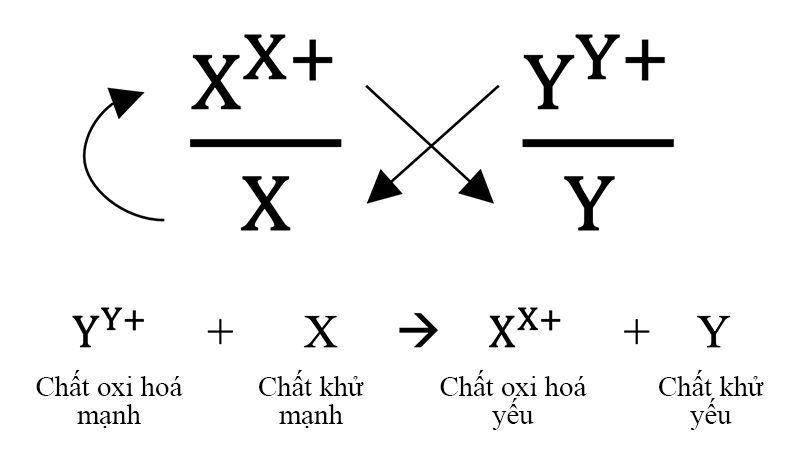
2. Nguyên tắc anpha
Giả sử có hai cặp oxi hóa khử: Xx+/ X và Yy+/Y (trong kia cặp Xx+/ X đứng trước cặp Yy+/Y trong hàng điện hóa). Áp dụng nguyên tắc alphaPhản ứng xảy ra theo chiều mũi tên như sau:
Trong đó:
m: khối lượng chất thu được ở năng lượng điện cực, tính bởi gam.A: trọng lượng mol nguyên tử của hóa học thu được ở năng lượng điện cực.n: Số electron nhưng mà nguyên tử hoặc ion đã mang đến hoặc nhận.I: Cường độ mẫu điện, tính bởi ampe (A).t: thời gian điện phân, tính bởi giây (s).F: Hằng số Faraday (F = 96 500 Culong/mol)Chương 6: kim loại kiềm, sắt kẽm kim loại kiềm thổ, nhôm
1. Tính lượng kết tủa lộ diện khi kêt nạp hết lượng CO2 vào dd Ca(OH)2 hoặc Ba(OH)2:
2. Tính lượng kết tủa xuất hiện khi hấp thụ hết lượng CO2 vào dd chứa hỗn hợp NaOH và Ca(OH)2 hoặc Ba(OH)2:
Trước hết tính: sau đó so sánh với nBa2+ hoặc nCa2+ để xem hóa học nào làm phản ứng hết3. Tính thể tích CO2 cần hấp thụ không còn vào dd Ca(OH)2 hoặc Ba(OH)2 chiếm được lượng kết tủa theo yêu thương cầu:
Trường thích hợp 1: nCO2 = n↓
Trường hòa hợp 2: nCO2 = nOH- – n↓
4. Tính Vdd NaOH đề nghị cho vào dd Al3+ để lộ diện lượng kết tủa theo yêu thương cầu:
Trường hòa hợp 1: nOH- = 3n↓
Trường hòa hợp 2: nOH- = 4nAl3+ – n↓
Kết trái trên tương xứng với hai trường đúng theo NaOH cần sử dụng thiếu với NaOH dùng dư.
Bạn đang xem: Trọn bộ công thức hóa cơ bản lớp 12
Trường vừa lòng 1 ứng với kết tủa không đạt cực đại; Trường hợp 2 ứng cùng với kết tủa sẽ đạt cực lớn sau kia tan giảm một phần.5. Tính Vdd HCl đề nghị cho vào dd Na
Trường vừa lòng 1: nH+ = n↓
Trường hợp 2: nH+ = 4nNa
Chương 7: sắt và một số kim các loại quan trọng
1. Tính trọng lượng muối sunfat thu được lúc hoà tan hết hỗn hợp kim loại bằng H2SO4 loãng giải phóng H2:
2. Tính trọng lượng muối clorua thu được khi hoà tan không còn hỗn kim loại tổng hợp loại bằng dd HCl giải tỏa H2:
3. Tính trọng lượng muối sunfat thu được lúc hoà rã hết các thành phần hỗn hợp oxit kim loại bằng H2SO4 loãng:
4. Tính cân nặng muối clorua thu được khi hoà chảy hết tất cả hổn hợp oxit sắt kẽm kim loại bằng dd HCl:
5. Tính cân nặng muối clorua thu được khi hoà tan không còn hỗn hợp kim loại bởi dd HCl vừa đủ:
6. Tính trọng lượng muối sunfat thu được lúc hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng hóa giải khí SO2:
7. Tính khối lượng muối sunfat thu được lúc hoà tan không còn hỗn hợp những kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2, S, H2S:
8. Tính số mol HNO3 cần dùng để làm hòa tan láo hợp các kim loại:
Lưu ý:
Không tạo nên khí làm sao thì số mol khí đó bằng 0. Giá trị nHNO3 không nhờ vào vào số sắt kẽm kim loại trong lếu hợp. Công thức này chỉ dùng khi mang lại hỗn hợp kim loại tính năng với HNO3.Chú ý khi công dụng với Fe3+ vày Fe khử Fe3+ về Fe2+ buộc phải số mol HNO3 đã dùng làm hoà chảy hỗn kim loại tổng hợp loại nhỏ tuổi hơn đối với tính theo phương pháp trên. Chính vì như thế phải nói rõ HNO3 dư bao nhiêu %.9. Tính số mol H2SO4 đặc, nóng cần dùng để làm hoà rã 1 hỗn hợp kim loại dựa theo thành phầm khử SO2 duy nhất:
10. Tính khối lượng muối nitrat sắt kẽm kim loại thu được khi cho hỗn hợp những kim loại chức năng HNO3 (không bao gồm sự chế tạo thành NH4NO3):
Lưu ý:
Không tạo ra khí như thế nào thì số mol khí đó bởi 0. Nếu tất cả sự tạo ra thành NH4NO3 thì thêm vào đó vào mNH4NO3 có trong dd sau phản bội ứng.11. Tính khối lượng muối thu được lúc cho các thành phần hỗn hợp sắt và các oxit sắt tác dụng với HNO3 dư hóa giải khí NO:
12. Tính cân nặng muối thu được lúc hoà tan hết hỗn hợp tất cả Fe, FeO, Fe2O3, Fe3O4 bởi HNO3 đặc, nóng, dư hóa giải khí NO2:
Lưu ý:
Hỗn phù hợp không độc nhất thiết đề xuất đủ tứ chất vẫn hoàn toàn có thể áp dụng được công thức.Dạng toán này, HNO3 buộc phải dư nhằm muối chiếm được là fe (III). Không được nói HNO3 toàn diện vì rất có thể phát sinh fe dư khử Fe3+ về Fe2+ :Nếu giải phóng tất cả hổn hợp NO với NO2 thì phương pháp là:13. Tính khối lượng muối thu được lúc hoà tan hết hỗn hợp bao gồm Fe, FeO, Fe2O3, Fe3O4 bởi H2SO4 đặc, nóng, dư hóa giải khí SO2:
Lưu ý: Hỗn hòa hợp không duy nhất thiết nên đủ 4 chất vẫn hoàn toàn có thể áp dụng được công thức.
14. Tính trọng lượng sắt đã cần sử dụng ban đầu, biết oxi hoá lượng sắt này bằng oxi được tất cả hổn hợp rắn X. Hoà tan không còn rắn X vào HNO3 loãng dư được NO:
15. Tính trọng lượng sắt đã sử dụng ban đầu, biết oxi hoá lượng fe này bởi oxi được tất cả hổn hợp rắn X. Hoà tan không còn rắn X trong HNO3 loãng dư được NO2:
16. Tính thể tich khí NO (hoặc NO2) nhận được khi cho hỗn hợp thành phầm sau phản nghịch ứng nhiệt độ nhôm (hoàn toàn hoặc không hoàn toàn) chức năng với HNO3:
17. Tính m gam Fe3O4 khi dẫn khí co qua, nung nóng một thời gian, rồi hoà chảy hết hỗn hợp rắn sau phản bội ứng bằng HNO3 loãng dư được khí NO là duy nhất:
18. Tính m gam Fe3O4 lúc dẫn khí co qua, nung nóng 1 thời gian, rồi hoà rã hết tất cả hổn hợp rắn sau phản nghịch ứng bằng H2SO4 đặc, nóng, dư được khí SO2 là duy nhất:
Lưu ý:
Khối lượng Fe2O3 khi dẫn khí teo qua, nung nóng 1 thời gian, rồi hoà chảy hết các thành phần hỗn hợp rắn sau phản nghịch ứng bằng H2SO4 đặc, nóng, dư được khí SO2 là duy nhất:
Một số phương pháp tính nhanh đồng phân dễ nhớ
Số đồng phân ancol đối kháng chức no CnH2n+2O:
Công thức: Số ancol CnH2n+20 = 2n-2 (n = 6)
Ví dụ : Tính số đồng phân ancol no, đối chọi chức, mạch hở từ
C3 – C5 C3H7OH: 23-2 = 2 đồng phân.
Xem thêm: Ở Trong Nhà Có Nên Dùng Kem Chống Nắng Hàng Ngày Không?? Ở Trong Nhà Có Nên Bôi Kem Chống Nắng Không
Số đồng phân amin đơn chức no CnH2n+3N
Công thức: Số amin CnH2n+3N = 2n-1 (n = 5)
Cách tính số đồng phân Ankin CnH2n-2 (n ≥ 2)
Mẹo tính cấp tốc đồng phân ankin:
Xét 2C với nối ba, mỗi C đã ghép với cùng 1 nhóm cố gắng (giống | hoặc không giống nhau).
Ví dụ với C4H6: Trừ đi 2C mang nối tía sẽ còn 2C cùng H là đội thế. C1 C2 1C 1C 1H đồng phân 2C H1 đồng phân. Ta gồm 2 đồng phân ankin.
Số đồng phân axit cacboxylict đối kháng chức no CnH2nO2
Công thức: Số axit CnH2nO2 = 2n-3 (n
Số đồng phân andehit solo chức no CnH2nO
Công thức: Số andehit CnH2nO = 2n-3 (n
Áp dụng: Tính số đồng phân anđehit sau: C3H6O, C4H8O
C3H60, C4H8O là phương pháp của anđehit no, đối kháng chức, mạch hở.
Với C3H60: 23-3 = 1 đồng phân: CH3CH2CHO
Với C4H80: 24-3 = 2 đồng phân: CH3CH2CH2CHO; (CH3)2CHCHO
Số đồng phân este solo chức no CnH2nO2
Công thức: Số este CnH2n02 = 2n-2 (n
Dãy điện hóa yêu cầu nhớ
K Na bố Ca Mg Al Zn
Khi nào Bà bé May Áo Dài
Fe Ni Sn Pb H
Phái tín đồ Sang Phố Hỏi
Cu Hg Ag Pt Au
Cửa Hiệu Á Phi Âu.
Hoặc họ cũng có thể sử dụng mẹo học thuộc hàng điện hóa khác
Lúc khác cha Cần đề nghị Mang Áo Giáp tất cả Sắt2/Sắt phải sang Phố Sắt3/Sắt Hỏi shop Sắt3/Sắt2 Hiệu Á Phi Âu
Li−K−Ba−Ca−Na−Mg−Al−Zn−Cr−Fe2+/Fe−Ni−Sn−Pb−Fe3+/Fe−H−Cu−Hg− Fe3+/ Fe2+−Hg−Ag−Pt−Au
Tải tệp tin tổng hợp bí quyết hoá học 12 đầy đủ nhất
Với bài viết tổng hợp bí quyết hóa học 12 của Bamboo trên đây. Hi vọng các chúng ta có thể dễ dàng nắm rõ kiến thức của chương trình học lớp 12 và chuẩn bị tốt nhất mang đến kì thi tốt nghiệp nhé! Các chúng ta có thể các em cùng tìm hiểu thêm một số tài liệu bổ ích liên quan tới các môn học tập khác trong quá trình học tập.










